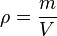Materia
Es todo aquello que ocupa un lugar en el espacio que tiene masa posee una cierta cantidad de energía, y está sujeto a cambios en el tiempo y a interacciones con aparatos de medida.


MEZCLA HOMOGÉNEA: Es una mezcla de sustancias que pueden ser distinguidas a simple vista.
MEZCLA HETEROGÉNEA: Es una mezcla de sustancias que no pueden ser distinguidas a simple vista.
SUSTANCIAS PURAS: Es un compuesto o elemento formado por átomos.
Clasificación de los elementos
*METALES: Son enlaces químicos caracterizados por ser buenos conductores de calor y la electricidad. Poseen alta densidad y son sólidos en temperaturas normales (excepto el mercurio); sus sales forman iones electropositivos (cationes) en disolución.
*NO METALES: Poseen, generalmente, entre cinco y siete electrones en su última órbita. Debido a esa propiedad, en lugar de ceder electrones su tendencia es ganarlos para poder completar
ocho en su última órbita. Los no metales son malos conductores del
calor y la electricidad, no poseen brillo, no son maleables ni dúctiles
y, en estado sólido, son frágiles.
*METALOIDES: Son
elementos que poseen, generalmente, cuatro electrones en su última
órbita, por lo que poseen propiedades intermedias entre los metales y
los no metales. Esos elementos conducen la electricidad solamente en un
sentido, no permitiendo hacerlo en sentido contrario como ocurre en los
metales.
Energía
Todo lo que necesita un objeto para realizar un trabajo es "energía"
Los tipos de enegía son:
- POTENCIAL: Es la energía que tiene un objeto interte por el simple hecho de acupar un espacio.
- CINÉTICA: Es aquella que tiene un lugar en movimiento.
- MECÁNICA: Es la suma de la energía potencial y la energía cinética.
Densidad
En física y
química, la densidad (símbolo p) es una
magnitud escalar referida a la cantidad de
masa contenida en un determinado
volumen de una
sustancia. La densidad media es la razón entre la masa de un cuerpo y el volumen que ocupa.
Iones
Los iones son elementos que fueron transfomados debido a la ganancia o a la perdida de electrónes.
*CATIONES: Los cationes son elementos metálicos que han perdido electrones y se dividen en dos:
-MONOATÓMICOS: Son cateones formados por un solo átomo del mismo elemento.
-POLIATÓMICOS: Son cateones formados por 2 o más átomos de diferentes elementos.
*ANIONES: Son elementos no metálicos que han ganado electrónes y se dividen en dos:
-MONOATÓMICOS: Son aniones formados por un solo átomo del mismo elemento.
-POLIATÓMICOS: Son aniones formados por dos o más átomos de diferentes elementos.
Nomenclaturas:
"Sales Binarias"
Se forman por un metal y un no metal:
Cloruro de sodio
Esta
conformado por un metal y un no metal el metal es un catión (positivo) y el no
metal es un anión (negativo) , el metal tiene terminación en “uro”.
Halógenos
No metales
Cl
Cloruro S2 Sulfuro
Br Bromuro Se2 Seleniuro
F
Fluoruro P3 Fosfuro
I
Yoduro N3 Nitruro
H Hidruro
"Ácidos Binarios"
Acido
clorhídirco
Estan compuestos por dos no metales, de los cuales el primero siempre es HIDRÓGENO.
H (Metal) Cl (No metal) (Halogeno).
Se le agrega
al principio el termino ácido y al no metal la terminación hídirco.
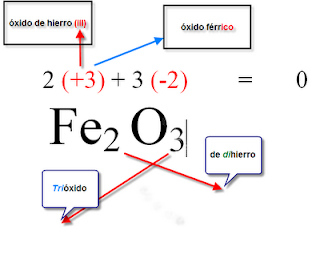
"Óxidos"
Oxidos Metálicos

Estan formados siempre por un no metal y terminan con uno o varios oxígenos dependiendo de la carga del catión metálico.
Oxidos No Metálicos
Están formados por un metal y terminan con uno o varios oxígenos dependiendo del ion formado por el no metal.
 Las terminaciones dependeran de la cantidad de átomos presentes de cada elemento:
Las terminaciones dependeran de la cantidad de átomos presentes de cada elemento:
Con
los oxidos metalicos se utiliza la nomeclatura por sufijo donde ICO se usa con
la valencia mas grande y OSO con la valencia mas pequeña
También
se utiliza la la nomeclatura stock que se basa en números romanos según su
valencia
"Ácidos Ternarios"
Compuesto por 3 No Metales de los uales del primero siempre es un Hidrógeno.
Todos tendrán la terminación ico (mayor cantidad de oxígenos) y oso (menos de oxígenos)
"Sales Ternarias"
Son moléculas o compuestos formados por 3 elementos uno de ellos METAL y los otros dos NO METALES.
Estan compuestos por 1 catión y 1 anión poliatómico, los cuales se unen dependiendo de sus cargas para formar una molécula neutra o sin carga.
ITO menos oxigenos
ATO
más oxigenos
Son moléculaso compuestos formados por 3 elementos uno de ellso es METAL y los otros 2 NO METALES.
Estan compuestos por 1 catíon monoatómico y 1 anión poliatómico, los cuales se unen dependiendo de sus cargas para formar una molécula neutra o sin carga.
El anión poliatómico que le da el nombre a las bases se llama hidróxido y tiene la estructura (OH)